❖本調査レポートの見積依頼/サンプル/購入/質問フォーム❖
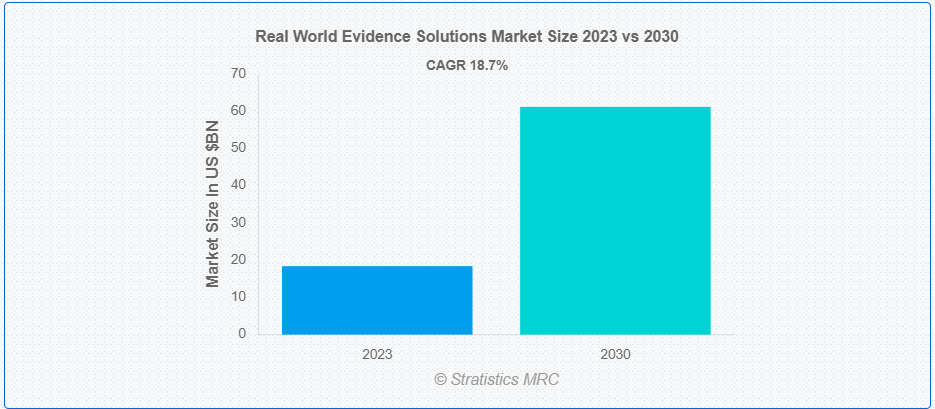
Stratistics MRCによると、世界のリアルワールドエビデンスソリューション市場は2023年に184億ドルを占め、予測期間中の年平均成長率は18.7%で、2030年には612億ドルに達すると予測されている。電子カルテ(EMR)、請求・クレームデータ、製品・疾患登録、モバイル機器や健康アプリで収集されたデータなど、従来とは異なるさまざまな臨床研究環境から得られる医療データは、リアルワールドエビデンスソリューションと呼ばれています。RWEソリューションには、電子カルテ、請求データベース、患者登録などのソースからのデータを活用し、臨床試験の管理された環境外で医療介入の安全性、有効性、費用対効果に関する洞察を生み出す、さまざまなツールや方法論が含まれます。
世界高齢化人口報告書によると、2020年のハイライトでは、全世界で約7億2700万人が65歳以上の高齢者であり、その数は2050年には15億人に達すると予想されている。
市場のダイナミクス:
ドライバー
患者中心の医療への関心の高まり
従来の臨床試験では、患者の経験や転帰が現実のシナリオを十分に反映していない可能性がある。患者中心のケアへのシフトに伴い、患者の日常生活において治療がどのように行われるかを理解することの重要性がますます認識されるようになっています。RWEソリューションは、電子カルテ、患者登録、ウェアラブルデバイスなどのソースから実世界のデータを活用することで、このパラダイムにおいて重要な役割を果たします。さらに、このデータを分析することで、医療関係者は患者の嗜好、治療アドヒアランス、介入の実世界での有効性に関する洞察を得ることができます。
拘束:
高い導入コスト
堅牢なRWE能力を確立するには、インフラ、テクノロジー、人材獲得、継続的なメンテナンスに多額の投資を行う必要がある。実世界の多様なデータ・ソースを収集、統合、分析するために必要なデータ・インフラを開発するには、多額の資金が必要となる。しかし、機械学習や自然言語処理などの高度な分析ツールや手法を導入するには、ソフトウェアのライセンス、カスタマイズ、トレーニングに多額の費用がかかる。データサイエンティスト、生物統計学者、領域専門家で構成される学際的チームの構築は、RWEイニシアチブの総コストを増加させる。
チャンスだ:
データ分析の進歩
医療データの量と複雑さが指数関数的に増加し続ける中、データ分析におけるイノベーションは、利害関係者が大規模な実世界データセットから意味のある洞察を抽出する力を与えている。機械学習、人工知能、自然言語処理などの技術により、電子カルテ、請求データベース、患者登録などの多様な実世界データソースから、パターン、相関関係、傾向を特定することが可能になります。このような分析能力により、確実な実世界エビデンスの生成が促進されるだけでなく、データ分析プロセスの効率と精度が向上します。
脅威だ:
プライバシーとデータ・セキュリティへの懸念
医療の意思決定における実データ(RWD)への依存度が高まる中、機密性の高い患者情報のプライバシーとセキュリティを確保することが最重要課題となっています。GDPRやHIPAAなどの厳格なデータ保護規制への準拠は、RWEの取り組みに複雑さとコストをもたらします。利害関係者は、患者データの使用、共有、保護にまつわる倫理的、法的な考慮事項をナビゲートしなければなりません。データ漏洩、不正アクセス、個人健康情報の悪用などの潜在的リスクは、これらの懸念をさらに悪化させ、RWEソリューションに対する信頼と信用を損ないます。
Covid-19の影響:
医療業界が前例のない課題に直面する中、リアルワールドデータ(RWD)の需要が急増し、ウイルスの影響を理解し、治療効果を評価し、公衆衛生上の対応に情報を提供するためのRWEソリューションの採用が推進されました。RWEは、パンデミックの緊急性の中で迅速な臨床的意思決定を促進し、再利用のための既存薬の安全性と有効性を評価する上で重要な役割を果たしました。しかし、パンデミックはデータアクセス、質、インフラにおける既存の格差を浮き彫りにし、リアルワールドエビデンスソリューションを効果的に活用する上での課題を悪化させました。
医療機器開発分野は予測期間中最大となる見込み
医療機器開発セグメントは、規制当局が医療機器の承認と市販後サーベイランスをサポートするために、堅牢な実世界データをますます要求しているため、予測期間中に最大のシェアを維持すると予想されます。RWEソリューションにより、メーカーは機器の安全性、有効性、実世界での性能に関するエビデンスを作成し、規制当局の期待に沿い、市場参入を促進することができます。さらに、価値ベースの医療へのシフトと患者の転帰の重視は、従来の臨床試験を超えた包括的なエビデンスを必要としています。
予測期間中、データセット分野のCAGRが最も高くなる見込み
データセットセグメントは、実用的なインサイトを生成するための基盤を提供する上で重要な役割を果たすため、推定期間を通じて市場の最大シェアを占めた。電子カルテ(EHR)、請求データベース、患者登録、ウェアラブル、健康の社会的決定要因などの情報源から多様で広範なデータセットを利用できるようになり、RWE生成の可能性が飛躍的に拡大した。さらに、これらの豊富なデータセットは、現実世界の設定における患者集団、治療経路、医療成果の包括的なビューを提供する。
最もシェアの高い地域:
中国、インド、日本、韓国のような国々における急速な都市化、人口増加、医療費の増加が、エビデンスに基づく医療ソリューションへの需要を高めているため、アジア太平洋地域が予測期間で最大の市場シェアを占めた。医療の意思決定におけるリアルワールド・エビデンス・ソリューションの利用を促進する規制改革とイニシアチブが、同地域の市場成長を加速させている。さらに、デジタルヘルスインフラの地域的拡大と電子カルテの採用により、膨大な量の実世界データが生成され、RWE活用の機会が生まれています。
CAGRが最も高い地域:
アジア太平洋地域は、医薬品承認、市場参入、市販後調査のためのRWEの使用を促進する政策やイニシアチブの実施により、支配期間を通じて収益性の高い成長を目撃すると予測されています。外国臨床試験データの受け入れや迅速な医薬品承認プロセスの確立を含む中国の規制改革は、製薬企業によるRWEソリューションの採用を促進しています。さらにインドでは、規制プロセスの合理化とイノベーションの促進を目指した取り組みにより、RWE活用のための環境が整いつつあります。
市場の主要プレーヤー
リアルワールドエビデンスソリューション市場の主要企業には、Cegedim Health Data、Clinigen Group plc、Flatiron Health Inc、IBM Corporation、IQVIA Holdings Inc、Medpace Holdings Inc、Parexel International Corporation、PerkinElmer Inc、PPD Inc、Syneos Healthなどがある。
主な進展
2023年8月、Targe RWEは、高度な疫学的手法と信頼性の高い統計原理を活用してデータを可視化・分析し、医薬品のライフサイクル全体を通じてアンメットニーズや戦略的懸念に対応する最先端の分析ソリューションの革新的な製品ラインを立ち上げました。
2023年6月、サーモフィッシャーサイエンティフィックは、CorEvitas, LLCをAudax Private Equityから現金9億1250万米ドルで買収する最終合意を発表した。
ハイブリッド型・分散型臨床試験テクノロジー・ソリューションのプロバイダーであるキャスター社は、2022年11月、市販後臨床試験を簡素化する新たなサービスを開始した。
2022年9月、ルーマニティ社は、米国と欧州を拠点とするリアルワールド・エビデンスの専門家で構成される新しいグローバル・プラクティスの創設を発表した。その目的は、クライアントが正しいリアルワールドデータ(RWD)と方法論を特定するのを支援することである。
2022年9月、ベラントスはVerantos Evidence Platformの立ち上げを発表した。このシステムにより、製薬会社は、米国FDAの承認を受けた高度に定義された基準で、実世界のエビデンスソリューションを生成できるようになった。
2022年6月、ドバイ保健当局(DHA)とその医療保険規制機関は、同州でバリュー・ベースの医療を導入するための「初の」デジタル主導のプログラムを開始した。
2022年5月、ファイザー社は、ESMO Breast Cancer 2022において、転移性乳癌を治療する併用療法に関するポジティブなリアルワールドエビデンスを発表した。この併用療法にはIBRANCE(パルボシクリブ)とアロマターゼ阻害薬が含まれる。
2022年3月、ISPOR-The Professional Society for Health Economics and Outcomes Research (HEOR)は、Bristol Myers Squibb-Pfizer Allianceと共同で、新しい “About Real World Evidence “マイクロサイトの立ち上げを発表した。
2022年3月、サーモ・フィッシャーとシンフォジェンの協力関係は、革新的ながん治療法の発見と開発を支援するデータワークフローの改善にも拡大された。
IQVIAは2022年1月、VYVGARTの新たな適応症の臨床開発を加速させるため、Argenex SEと提携した。さらに、IQVIAの科学的助言と技術を活用し、アルジェネックス社の臨床開発を支援する。
対象コンポーネント
– サービス
– データセット
– その他のコンポーネント
対象となる展開
– クラウドベース
– オンプレミス
対象アプリケーション
– 医療機器開発
– 医薬品開発
– 市販後調査
– 臨床および規制上の意思決定
– その他のアプリケーション
対象となるエンドユーザー
– 医療機関
– 医療費支払者
– ヘルスケア企業
– 製薬会社
– 患者支援団体
– その他のエンドユーザー
対象地域
– 北米
米国
カナダ
メキシコ
– ヨーロッパ
o ドイツ
イギリス
o イタリア
o フランス
o スペイン
o その他のヨーロッパ
– アジア太平洋
o 日本
o 中国
o インド
o オーストラリア
o ニュージーランド
o 韓国
o その他のアジア太平洋地域
– 南アメリカ
o アルゼンチン
o ブラジル
o チリ
o その他の南米諸国
– 中東・アフリカ
o サウジアラビア
o アラブ首長国連邦
o カタール
o 南アフリカ
o その他の中東・アフリカ
レポート内容
– 地域レベルおよび国レベルセグメントの市場シェア評価
– 新規参入企業への戦略的提言
– 2021年、2022年、2023年、2026年、2030年の市場データをカバー
– 市場動向(促進要因、制約要因、機会、脅威、課題、投資機会、推奨事項)
– 市場予測に基づく主要ビジネスセグメントにおける戦略的提言
– 主要な共通トレンドをマッピングした競合のランドスケープ
– 詳細な戦略、財務、最近の動向を含む企業プロファイリング
– 最新の技術進歩をマッピングしたサプライチェーン動向
無料カスタマイズの提供:
本レポートをご購入いただいたお客様には、以下の無料カスタマイズオプションのいずれかをご提供いたします:
– 企業プロファイリング
o 追加市場プレーヤーの包括的プロファイリング(3社まで)
o 主要企業のSWOT分析(3社まで)
– 地域セグメンテーション
o 顧客の関心に応じた主要国の市場推定、予測、CAGR(注:フィージビリティチェックによる)
– 競合ベンチマーキング
製品ポートフォリオ、地理的プレゼンス、戦略的提携に基づく主要企業のベンチマーキング
1 エグゼクティブ・サマリー
2 序文
2.1 概要
2.2 ステークホルダー
2.3 調査範囲
2.4 調査方法
2.4.1 データマイニング
2.4.2 データ分析
2.4.3 データの検証
2.4.4 リサーチアプローチ
2.5 リサーチソース
2.5.1 一次調査ソース
2.5.2 セカンダリーリサーチソース
2.5.3 前提条件
3 市場動向分析
3.1 はじめに
3.2 推進要因
3.3 抑制要因
3.4 機会
3.5 脅威
3.6 アプリケーション分析
3.7 エンドユーザー分析
3.8 新興市場
3.9 コビッド19の影響
4 ポーターズファイブフォース分析
4.1 供給者の交渉力
4.2 買い手の交渉力
4.3 代替品の脅威
4.4 新規参入の脅威
4.5 競争上のライバル
5 実世界証拠ソリューションの世界市場、コンポーネント別
5.1 はじめに
5.2 サービス
5.3 データセット
5.3.1 異なるデータセット
5.3.1.1 薬局データ
5.3.1.2 患者主導データ
5.3.1.3 クレームデータ
5.3.1.4 臨床設定データ
5.3.1.5 レジストリに基づくデータセット
5.3.2 統合データセット
5.4 その他の構成要素
6 リアルワールドエビデンスソリューションの世界市場、展開別
6.1 導入
6.2 クラウドベース
6.3 オンプレミス型
7 リアルワールドエビデンスソリューションの世界市場:用途別
7.1 はじめに
7.2 医療機器開発
7.3 医薬品開発
7.3.1 がん領域
7.3.2 神経学
7.3.3 免疫学
7.3.4 循環器疾患
7.4 市販後調査
7.5 臨床および規制上の意思決定
7.6 その他のアプリケーション
8 リアルワールドエビデンスソリューションの世界市場、エンドユーザー別
8.1 はじめに
8.2 医療機関
8.3 医療費支払者
8.4 医療関連企業
8.5 製薬会社
8.6 患者擁護団体
8.7 その他のエンドユーザー
9 リアルワールドエビデンスソリューションの世界市場、地域別
9.1 はじめに
9.2 北米
9.2.1 米国
9.2.2 カナダ
9.2.3 メキシコ
9.3 ヨーロッパ
9.3.1 ドイツ
9.3.2 イギリス
9.3.3 イタリア
9.3.4 フランス
9.3.5 スペイン
9.3.6 その他のヨーロッパ
9.4 アジア太平洋
9.4.1 日本
9.4.2 中国
9.4.3 インド
9.4.4 オーストラリア
9.4.5 ニュージーランド
9.4.6 韓国
9.4.7 その他のアジア太平洋地域
9.5 南米
9.5.1 アルゼンチン
9.5.2 ブラジル
9.5.3 チリ
9.5.4 その他の南米地域
9.6 中東・アフリカ
9.6.1 サウジアラビア
9.6.2 アラブ首長国連邦
9.6.3 カタール
9.6.4 南アフリカ
9.6.5 その他の中東・アフリカ地域
10 主要開発
10.1 契約、パートナーシップ、提携、合弁事業
10.2 買収と合併
10.3 新製品上市
10.4 事業拡大
10.5 その他の主要戦略
11 会社プロファイル
11.1 セゲディム・ヘルスデータ
11.2 クリニゲングループ plc
11.3 フラットアイアン・ヘルス社
11.4 IBMコーポレーション
11.5 IQVIAホールディングス
11.6 メドスペース・ホールディングス
11.7 パレクセル・インターナショナル・コーポレーション
11.8 パーキンエルマー
11.9 PPD Inc.
11.10 シネオス・ヘルス
表一覧
1 リアルワールドエビデンスソリューションの世界市場展望、地域別(2021-2030年) ($MN)
2 リアルワールドエビデンスソリューションの世界市場展望、コンポーネント別(2021-2030年) ($MN)
3 リアルワールドエビデンスソリューションの世界市場展望:サービス別 (2021-2030) ($MN)
4 リアルワールドエビデンスソリューションの世界市場展望、データセット別 (2021-2030) ($MN)
5 リアルワールドエビデンスソリューションの世界市場展望、異種データセット別 (2021-2030) ($MN)
6 リアルワールドエビデンスソリューションの世界市場展望、統合データセット別 (2021-2030) ($MN)
7 リアルワールドエビデンスソリューションの世界市場展望、その他のコンポーネント別 (2021-2030) ($MN)
8 リアルワールドエビデンスソリューションの世界市場展望、展開別 (2021-2030) ($MN)
9 実世界証拠ソリューションの世界市場展望、クラウドベース別 (2021-2030) ($MN)
10 実世界証拠ソリューションの世界市場展望:オンプレミス型別 (2021-2030) ($MN)
11 リアルワールドエビデンスソリューションの世界市場展望、用途別 (2021-2030) ($MN)
12 リアルワールドエビデンスソリューションの世界市場展望:医療機器開発別 (2021-2030) ($MN)
13 リアルワールドエビデンスソリューションの世界市場展望:医薬品開発別 (2021-2030) ($MN)
14 リアルワールドエビデンスソリューションの世界市場展望:腫瘍学別 (2021-2030) ($MN)
15 リアルワールドエビデンスソリューションの世界市場展望:神経学別 (2021-2030) ($MN)
16 リアルワールドエビデンスソリューションの世界市場展望:免疫学別 (2021-2030) ($MN)
17 リアルワールドエビデンスソリューションの世界市場展望:循環器疾患別 (2021-2030) ($MN)
18 リアルワールドエビデンスソリューションの世界市場展望、市場参入後ベライアンス別 (2021-2030) ($MN)
19 リアルワールドエビデンスソリューションの世界市場展望、臨床および規制上の意思決定別 (2021-2030) ($MN)
20 リアルワールドエビデンスソリューションの世界市場展望、その他の用途別 (2021-2030) ($MN)
21 リアルワールドエビデンスソリューションの世界市場展望:エンドユーザー別 (2021-2030) ($MN)
22 リアルワールドエビデンスソリューションの世界市場展望:医療機関別 (2021-2030) ($MN)
23 リアルワールドエビデンスソリューションの世界市場展望:医療費支払者別 (2021-2030) ($MN)
24 リアルワールドエビデンスソリューションの世界市場展望:ヘルスケア企業別 (2021-2030) ($MN)
25 リアルワールドエビデンスソリューションの世界市場展望:医薬品別 (2021-2030) ($MN)
26 リアルワールドエビデンスソリューションの世界市場展望:患者擁護団体別 (2021-2030) ($MN)
27 リアルワールドエビデンスソリューションの世界市場展望、その他のエンドユーザー別 (2021-2030) ($MN)
注:北米、欧州、APAC、南米、中東・アフリカ地域の表も上記と同様に表現しています。
❖本調査資料に関するお問い合わせはこちら❖